


La vita di Alessio Tavecchio
27 Gennaio 2019


1984 – Nineteen Eighty-Four
27 Gennaio 2019RELAZIONE DI LABORATORIO DI CHIMICA
Cavenati Aryo Classe VF 21/11/2006
? Obbiettivo :
Osservare lelettrolisi dell’acqua, annotare gli eventuali dati ed osservarne i risultati.
? Materiali :
– Voltmetro di Hoffmann – Alternatore
– cavi elettrici – cronometro
– provette – fiammiferi
Figura1


Voltmetro di Hoffmann collegato all’alternatore
? Sostanze : – Acqua Distillata (H2O) -Acido Cloridrico (HCl)
? Procedimento
1. Collegare il voltmetro di Hoffmann e l’alternatore(figura1)
2. Riempire il voltmetro di Hoffmann di H2O. Aggiungere alcune gocce di HCl.
3. Accendere l’alternatore ad 8V. Annotare la diminuzione di livello dell’acqua nelle due burette rovesciate” dellapparecchio di Hoffamnn ogni 5 minuti fino a 20 minuti e alla fine, dove vi è una minore riduzione di livello, accendere un fiammifero, spegnerlo, aprire il rubinetto della buretta e avvicinare il fiammifero spento all’apertura. Nell’altra buretta, accendere e spegnere un altro fiammifero, prendere una provetta, aprire il rubinetto e chiudere l’apertura con la provetta e dopodiché mettere dentro la provetta il fiammifero appena spento.
4. Rifare il punto 3, ma questa volta accendere l’alternatore a 5V, aumentandolo di 1V ogni minuto(fino a 10 minuti).
? Osservazioni
1. Si ha dopo alcuni minuti la formazione dei gas nelle due burette. Analizzando i dati riportati sulla tabella 1 e tabella 2 è possibile notare che nelle burette in cui si ha maggiore diminuzione di livello, dovuta al maggiore volume occupato dai gas liberati, vi è la presenza di H2, e in quella minore invece vi è la presenza di O2. Lo si può verificare anche con la prova del fiammifero: dove è presente l’ossigeno, il fiammifero spento viene ravvivato; dove è presente l’idrogeno invece se si catturano alcune molecole all’interno di una provetta e in questa viene messo un fiammifero spento, si ha una scocca.
2. La differenza di quantità fra i due gas liberati è dovuta alla formula dell’acqua stessa, ossia H2O, in cui gli atomi di H sono di superiore quantità rispetto agli atomi di O.
3. Il pallone” situato in mezzo al voltmetro di Hoffmann è necessario perché H2O(aq) viene spinto dai gas liberati(che occupano maggior volume), ed esso ha bisogno di altri spazi da occupare.
? Riferimenti Teorici
1. L’elettrolisi (che la parola stessa significa “rompere con l’elettricità”) è un processo che trasforma energia elettrica in energia chimica. E’ il processo inverso a quello della pila. Con la pila infatti si sfrutta una reazione chimica per produrre energia elettrica, con l’elettrolisi invece si usa l’energia elettrica per far decorrere una reazione chimica(red-ox) che non avverrebbe spontaneamente.
2. Il dispositivo in cui avviene lelettrolisi viene chiamato cella elettrolitica.
3. Una cella elettrolitica si realizza immergendo nell’ambiente di reazione due elettrodi(i cavi elettrici) collegati con una sorgente di corrente continua (l’alternatore). In tal modo i due elettrodi assumono cariche opposte.
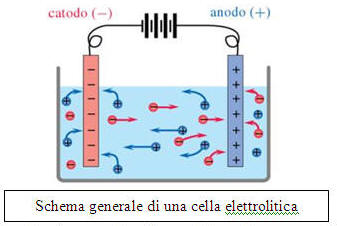

I cationi migrano al polo negativo(il catodo), e da esso acquistano elettroni riducendosi. Contemporaneamente gli anioni attratti dal polo positivo(lanodo), gli cedono elettroni ossidandosi.
Le reazioni sono:
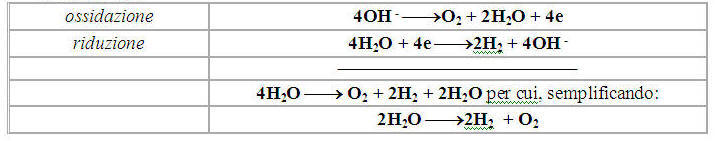

4. Si può osservare che nella cella elettrolitica anodo e catodo presentano polarità opposte rispetto a quelle dellanodo e del catodo nella pila, ma in entrambi i casi allanodo si ha unossidazione e al catodo una riduzione. Linversione dei segni degli elettrodi nei due processi si spiega osservando che nelle pile gli elettrodi assumono una carica in conseguenza di una reazione spontanea, mentre nella cella elettrolitica i segni degli elettrodi derivano dalla d.d.p imposta dall’esterno.
5. LHCl è stato impiegato come unelettrolita. Con il termine elettrolita si indica una molecola che si divide in catione ed anione quando viene dissolta in un solvente, solitamente acqua. L’elettrolita ha la funzione di condurre gli ioni prodotti da una reazione e consumati dall’altra, chiudendo il circuito elettrico all’interno della cella.
? Nota Storica
Lelettrolisi venne scoperto quasi casualmente nel 1800 da W. Nicholson e da A. Carlisle che, per migliorare il contatto tra una batteria e i fili a essa collegati, inumidirono i fili con acqua e osservarono lo sviluppo di bolle di gas. In esperimenti successivi i conduttori collegati alla batteria vennero immersi direttamente nell’acqua e si scoprì che in corrispondenza del polo positivo si sviluppa l’ossigeno, mentre in corrispondenza di quello negativo si formava idrogeno.
H.Davy scoprì che molte sostanze potevano essere decomposte facendo passare corrente in una loro soluzione acquosa o nella sostanza allo stato fuso. Una teoria completa si deve però a M.Faraday che introdusse anche termini anodo, catodo, anione, catione, ione ed elettrodo.


M.Faraday
Roald Hoffmann (nato il 18 luglio, 1937 come Roald Safran — Hoffmann è il cognome del patrigno) è un chimico teorico di origini ebraiche e polacche; i sui studi sui meccanismi delle reazioni chimiche gli hanno valso il premio Nobel nel 1981.

Roald Hoffmann è nato a Z?oczów, in Polonia (oggi Ucraina) ed è stato chiamato Roald in onore dell’esploratore Norvegese Roald Amundsen. In seguito all’invasione della Polonia da parte di Hitler, venne rinchiuso insieme alla sua famiglia prima in un ghetto e poi in un campo di concentramento, dal quale riuscì a fuggire insieme alla madre nel 1939. Il padre fu invece ucciso dai nazisti durante un successivo tentativo di fuga. Dopo la seconda guerra mondiale fuggì dalla Polonia comunista con la madre e il patrigno, spostandosi in Cecoslovacchia, Austria, Germania e, infine, emigrando definitivamente negli Stati Uniti d’America nel 1949.
Qui, il giovane Hoffmann frequenta la Columbia University, dove si laurea in chimica e ottenendo poi il PhD ad Harvard con William N. Lipscomb, Jr. nel 1962. In seguito, iniziò la collaborazione con Robert Burns Woodward, sviluppando insieme a lui le regole per spiegare alcuni meccanismi di reazione (le regole di Woodward-Hoffmann). Queste ricerche gli valsero il Premio Nobel per la Chimica nel 1981, e la medaglia Priestley nel 1990.
In seguito, ha rivolto i sui studi, che prosegue tuttora, alle proprietà e il comportamento di sostanze organiche ed inorganiche e dei materiali, sviluppando il metodo extended Huckel che ha proposto nel 1963.
Attualmente insegna alla Cornell University in Ithaca, New York, alternando alla ricerca l’attività di divulgatore scientifico.
[Bibliografia : www.wikipedia.org; Motore di ricerca immagini Google; Libro di testo Chimica per Moduli B”]


