


La vita di Alessio Tavecchio
27 Gennaio 2019


1984 – Nineteen Eighty-Four
27 Gennaio 2019RELAZIONE DI LABORATORIO DI CHIMICA
Cavenati Aryo – Classe VF – 25/10/06
Obbiettivo:
– Costruire una Pila Daniel
– Verificare il passaggio di corrente elettrica nella pila costruitaMateriali:
– Agitatore – Bambagia
– Becher (4) – Bilancia elettronica
– Spatola – Tubo di vetro ad U (2)
– VoltmetroSostanze:
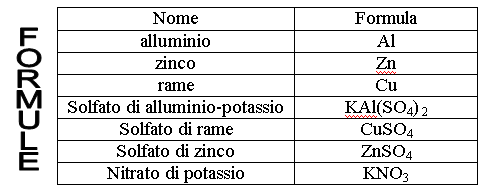
– Lamina di alluminio – Solfato di alluminio-potassio
– Lamina di rame (2) – Solfato di rame
– Lamina di zinco – Solfato di zinco
– Nitrato di potassio – Acqua distillata

Disegno
![]()
![]()

Procedimento
1. Pesare le lamine con l’ausilio di una bilancia elettronica.
2. Preparare una soluzione 1M di 120 ml di CuSO4,KAl(SO4)2,KNO3* e due di ZnSO4, ognuna in becher diversi: prelevare con le spatole le quantità esatte per le soluzioni con l’ausilio della bilancia elettronica, e successivamente diluire con l’acqua distillata. Agitare bene con lagitatore.
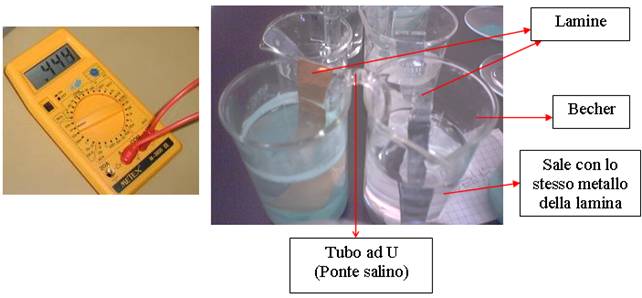
3. Preparare il ponte salino. Riempire i tubi ad U di soluzione 1M di KNO 3. Chiudere le estremità dei tubi con batuffoli di bambagia, in maniera tale che all’interno i batuffoli siano a contatto con la soluzione.
4. Mettere ogni lamina nel becher associandola al sale che contiene il metallo di cui è fatta la lamina stessa (esempio: una lamina di Cu nel becher contenente la soluzione di CuSO 4).
5. Collegare 2 becher con un ponte salino(vedi disegno), in modo da formare una pila Zn||Cu e una pila Al||Zn.
6. Verificare il funzionamento delle pile con il voltmetro. Mettere in contatto le estremità dei cavi del voltmetro con le lamine che si trovano in una stessa pila.
7. Dopo aver lasciato le 2 pile(vedi disegno) per alcuni giorni, pesare di nuovo le lamine.
· Osservazioni
1. Nella seguente tabella 1 vengono riportati il peso delle lamine prima e dopo e la differenza di potenziale(d.d.p) di riduzione delle pile misurata con il voltmetro.
|
TABELLA 1 |
Pila Zn||Cu |
Pila Al||Zn |
||
|
Zn |
Cu |
Al |
Zn |
|
|
Peso iniziale(g) |
7,05 |
0,53 |
8,87 |
5,45 |
|
Peso Finale(g) |
6,89 |
0,61 |
8,82 |
5,53 |
|
d.d.p(V) |
1,1 |
0,90 |
||
2. Nella seguente tabella 2 vengono riportate le quantità delle sostanze per ottenere soluzioni 1 M di 120 ml (0,12 l).
|
Sostanze |
Quantità(g) |
|
KAl(SO4)2 |
36,92 |
|
ZnSO4 |
19,37 |
|
CuSO4 |
19,15 |
|
*Per KNO3 preparare solo una piccola quantità, sufficiente per riempire i tubi ad U |
|
3. E possibile notare nella tabella 1 che le lamine hanno subito una variazione di peso. Nella pila Zn||Cu per esempio, il peso Zn è diminuito, mentre quello di Cu è aumentato.
4. Nella Pila Zn||Cu la d.d.p è maggiore rispetto a quella della pila Al||Zn.
5. Nella preparazione delle soluzioni, evitare i possibili errori. Per esempio:
· Versare la quantità di sostanza dopo l’acqua può comportare l’innalzamento dell’acqua stessa.
· Leggere le misure sul becher con gli occhi messi perpendicolarmente per evitare la paralassi.
· Riferimenti Teorici
1. i fenomeni osservati sono dovuti alla reazione di ossidoriduzione(red-ox). Una red-ox è composta da 2 semireazioni associate, l’ossidazione e la riduzione. In una red-ox la specie che si ossida cede i suoi elettroni, e cedendoli, riduce un’altra, ed è quindi un riducente; la specie che si riduce invece acquista gli elettroni, ed acquistandoli dall’altra(il riducente), la ossida ed è quindi un ossidante.
2. Una pila è costituita da 2 semicelle: la semicella dove avviene l’ossidazione, detta anodo, e la semicella dove avviene la riduzione, detta catodo. Nella pila Cu||Zn:
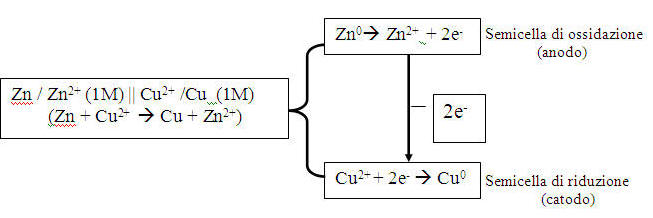

Zn si ossida: cede 2 elettroni diventando Zn2+ (per questo che il suo peso è diminuito;guardare le foto). Cu2+ invece si riduce: acquista i 2 elettroni e diventa Cu (per questo che il suo peso è aumentato). La determinazione della specie che si riduce o si ossida in una pila è legata ai valori di potenziale di riduzione di ogni specie(riportati nella tabella 3). Vediamo nella tabella che Cu ha maggior potere ossidante ed è più facilmente riducibile rispetto a Zn, che alla sua volta ha maggior potere riducente, ed è più facilmente ossidabile. E’ possibile calcolare la forza elettromotrice della pila Zn||Cu anche teoricamente, utilizzando i valori della tabella 3:
E = Ecatodo – Eanodo à E = ECu – EZn à E = 0,34 – (-0,76) = 1,10 V
Dove E sta per potenziale standard di riduzione.
Zn prima:


Zn dopo:


Lo stesso vale per la pila Al||Zn. In questa pila però, a differenza di prima, Zn funge da catodo e non da anodo, che questa volta è occupato da Al. Questo è perché Zn ha maggior potere ossidante ed è più facilmente riducibile rispetto a Al, che alla sua volta ha maggior potere riducente, ed è più facilmente ossidabile. Sempre utilizzando la tabella, è possibile notare di nuovo che la d.d.p della pila Zn||Cu è maggiore rispetto a quella della pila Al||Zn.
3. Le due semicelle sono collegate da un ponte salino (nella formula è rappresentato dalla doppia sbarra|| ). Esso permette la migrazione degli ioni al fine di mantenere elettricamente neutre e quindi riequilibrare la differenza di potenziale delle due semicelle.
Un po di storia…


All’inizio del 1830, Daniell era profondamente interessato al lavoro del suo amico Michael Faraday tanto è che l’orientamento principale dei suoi studi di allora era l’elettrochimica. Cercò di migliorare la pila di Volta. Un problema importante della pila di Volta era che non poteva fornire la corrente per un periodo di tempo continuo. Questa pila divenne famosa, e ancora oggi porta il nome dello scienziato che lo ha inventato.
Nel 1845 morì di apoplessia improvvisamente, mentre stava aspettando l’ennesima riunione della London Royal Society.
[Bibliografia: Wikipedia;



